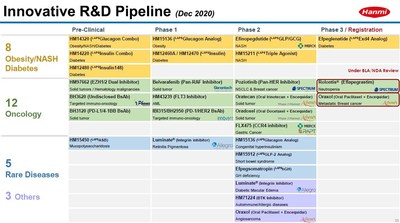
- Se espera la aprobación de Rolontis y Oraxol BLA/NDA por la FDA de EE.UU. este año
- El agonista LAPSTriple, un nuevo e innovador fármaco de triple acción para el tratamiento de NASH, indicación de expansión
- Efpeglenatide cumple la variable primaria para la Fase 3 global
- Esforzándose por desarrollar medicamentos para las enfermedades raras, como un medicamento de una vez al mes para el síndrome del intestino corto
SEUL, Corea del Sur, 18 de enero de 2021 /PRNewswire/ — Hanmi Pharmaceutical Co., Ltd. planea crear un logro global de I+D basado en innovaciones de tratamiento de la inflamación y la fibrosis, nuevo fármaco de triple acción para el tratamiento de NASH (esteatohepatitis no alcohólica), así como varias otras innovaciones en los campos de enfermedades metabólicas, oncología y enfermedades raras.


- Cuál será la estrategia de I+D de Hanmi para 2021 sobre nuevos medicamentos
En particular, se espera que dos nuevos medicamentos desarrollados por Hanmi Pharmaceutical Co., Ltd. sean aprobados por la FDA de los Estados Unidos este año. “Rolontis”, un tratamiento para la neutropenia que tenía su tecnología con licencia para Spectrum Pharmaceuticals, Inc. y “Oraxol”, que fue licenciado a Athenex, Inc. como tratamiento para el cáncer de mama metastásico, bajo revisión prioritaria por la FDA están a punto de anunciar los resultados de su aprobación BLA/NDA (solicitud de licencia de productos biológicos; BLA), respectivamente.
“Las capacidades de I+D de Hanmi Pharmaceutical Co., Ltd. y la fuerte confianza entre múltiples socios siguen siendo sólidas”, afirmó el Dr. Kwon, haciendo hincapié que “Los dos nuevos medicamentos serán aprobados por la FDA en el futuro más cercano, y la expectativa para la cartera de Hanmi en este año es incluso mayor que nunca.”

- Preanunciada la expansión de la indicación para el agonista LAPSTriple (HM15211)
El agonista LAPSTriple (HM15211), un triple agonista, ha demostrado un efecto de reducción del hígado graso del 50% o más a través de los recientes ensayos clínicos en los Estados Unidos y se está desarrollando para ser el tratamiento NASH más eficaz a nivel global. El efecto de reducción del hígado graso dentro de 12 semanas fue tan alto del 80% en comparación con el del grupo de control de placebo, y el efecto de reducción de la enzima hepática también fue estadísticamente significativo.
Basado en esto, el estudio clínico global en Fase 2 para el agonista LAPSTriple está actualmente en marcha, y ha recibido la designación Fast Track de la FDA para acelerar el desarrollo de medicamentos para NASH.
La FDA de EE.UU. también designó el agonista LAPSTriple (HM15211) como un medicamento huérfano para el tratamiento de la colangitis esclerosante primaria (PSC) y la colangitis biliar primaria (PBC) en 2020, y las indicaciones se ampliarán para incluir la fibrosis pulmonar idiopática (FF) y la enfermedad pulmonar obstructiva crónica (EPOC).
Un estudio clínico de fase 3 (Amplitude-M) sobre Efpeglenatide, que se está desarrollando como tratamiento para la diabetes, se completó recientemente y alcanzó la variable primaria al lograr con éxito “reducción de 30 semanas en hemoglobina glicada (HbA1c) en comparación con la de placebo” en cohortes de dosis. El estudio también confirmó su efecto de pérdida de peso, que era un punto final secundario. Hanmi Pharmaceutical Co., Ltd. está planeando maximizar los efectos del tratamiento combinando Efpeglenatide con otros nuevos medicamentos como el análogo LAPSGlucagon (HM15136).
Además, LAPSGLP/GCG(Efinopegdutide), que fue licenciado a MSD el año pasado, ha entrado en el ensayo clínico de Fase 2 este año, y el desarrollo como tratamiento de NASH se acelerará.
- Liderando el campo de la oncología a través de la innovación abierta
Hanmi Pharmaceutical Co., Ltd. también ha hecho hincapié en los planes intensivos de desarrollo en inmunooncología, inflamación y fibrosis, nuevas plataformas y enfermedades raras a través de la innovación abierta.
Poziotinib, que tuvo éxito en ensayos clínicos para pacientes con carcinoma de células no pequeñas mutadas (NSCLC) por HER2 el año pasado, está previsto que se presente a la aprobación de la FDA de EE.UU. este año. Belvarafenib (HM95573, tumor sólido), que fue licenciado a Genentech, Inc., está a punto de entrar en un estudio clínico global, y un estudio clínico de aumento de dosis y expansión en el inhibidor doble FLT3/SYK (HM43239), que ha demostrado remisión completa en pacientes con leucemia mieloide aguda (LMA) de mutación FLT3 que ningún tratamiento existente ha tratado con éxito, está en rápido progreso.
Hanmi Pharmaceutical Co., Ltd. también está persiguiendo sustancias de desarrollo de fármacos contra el cáncer dirigidas a células T mediante la identificación de sustancias preclínicas basadas en la tecnología de la plataforma de IA con Standigm, Inc. Además, se está investigando el potencial de la combinación de sustancia candidata contra el cáncer inmune oral (FLX475) de RAPT Therapeutics, Inc. con Keytruda de Merck como tratamiento contra el cáncer gástrico.
Al mismo tiempo, se está llevando a cabo un amplio estudio que involucra el anticuerpo biespecífico adoptado de Phanes Therapeutics, Inc. Este estudio tiene como objetivo aumentar el efecto contra el cáncer en el microambiente tumoral (TME) a través de la sinergia con Pentambody, que también es la tecnología de plataforma de anticuerpos biespecífica desarrollada por Beijing Hanmi Pharm. Co., Ltd.
Además, actualmente se está llevando a cabo en China un estudio clínico sobre el anticuerpo biespecífico PD-1/HER2 co-desarrollado con Innovent Biologics, Inc. para encontrar una dosis adecuada para pacientes con tumores sólidos.
- Buscando el desarrollo del tratamiento para enfermedades raras
Hanmi Pharmaceutical Co., Ltd. también planea centrarse en su papel como empresa farmacéutica para un pequeño número de pacientes con área de enfermedades raras en la que tiene altas necesidades no cubiertas.
El análogo LAPS GLP-2, que se está desarrollando como tratamiento para el síndrome del intestino corto, que se produce en tres por millón, confirmó su seguridad y un potencial de dosificación una vez al mes por primera vez en el ser humano, fase 1.
El análogo LAPSGLP-2 también fue designado como un medicamento huérfano por la FDA y la EMA en 2019 y posteriormente fue designado como un medicamento para enfermedades pediátricas raras (RPD) por la FDA en 2020. Entrará en un ensayo clínico de Fase 2 este año.
Además, el desarrollo de la hiperinsulinemia congénita (CHI) y el síndrome de la enfermedad de almacenamiento lisosomal (LSD), se encuentran bajo un progreso estable. En particular, el ensayo clínico de fase 2 sobre el tratamiento de la hiperinsulinemia congénita fue aprobado recientemente (el día 9) por la FDA, y el desarrollo se está acelerando.
Se Chang Kwon, consejero delegado de Hanmi Pharmaceutical Co., Ltd., dijo, “Hanmi Pharmaceutical Co., Ltd. llevará a cabo la misión de las empresas farmacéuticas, que es ofrecer el valor para las vidas humanas, especialmente en esta pandemia global de COVID-19. Planeamos hacerlo procediendo a los proyectos para hacer frente a la COVID-19, incluido el desarrollo de diagnósticos, vacunas y tratamientos. Además, haremos todo lo posible para satisfacer las expectativas hacia la I+D de Hanmi Pharmaceutical Co., Ltd. obteniendo la aprobación de la FDA para nuevos medicamentos, así como acelerando el progreso clínico para aumentar el valor de varias carteras.”

