– El nuevo inhibidor SGLT2 de Daewoong Pharmaceutical para el tratamiento de la diabetes demuestra un efecto destacable en un ensayo clínico de fase 2
– Daewoong anunció el resultado de enavogliflozin de ensayo clínico de fase 2 en pacientes coreanos con diabetes de tipo 2 en ICDM 2020
– Busca acelerar la I+D para la expansión del mercado global mediante el establecimiento de amplias asociaciones en el extranjero
SEÚL, Corea del sur, 29 de septiembre de 2020 /PRNewswire/ — Daewoong Pharmaceutical (Daewoong) (consejero delegado: Sengho Jeon) anunció los resultados de su ensayo de fase 2 de enavogliflozin, un nuevo inhibidor SGLT2, por primera vez en el Congreso Internacional de Diabetes y Metabolismo (ICDM) 2020 celebrado el 18 y 19 de septiembre.
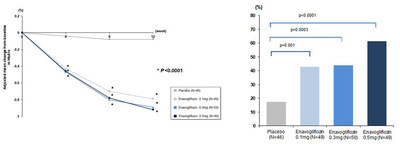
Cuando se administró enavogliflozin durante 12 semanas como monoterapia en pacientes diabéticos de tipo 2, los pacientes mostraron reducciones estadísticamente significativas en sus niveles de hemoglobina glicatada (HbA1c) en comparación con el placebo a partir de la semana 4. En la semana 12, los niveles de HbA1c de los pacientes se redujeron aproximadamente un 0,9%p en comparación con el placebo. Este es un resultado estadísticamente significativo e indica una reducción adicional en el HbA1c de aproximadamente 0,2–0,3%p en comparación con otros inhibidores SGLT2 para los que se realizaron ensayos en sujetos en los países de occidente. Este resultado, como tal, eleva las expectativas para más estudios.
El porcentaje de pacientes cuyo nivel de HbA1c > 7,0%* en la semana 12 fue tan alto como de un 61%, lo que supuso un aumento de más del 20%p desde aquellos pacientes en los ensayos realizados en los inhibidores existentes SGLT2. Además, el porcentaje de pacientes que lograron una reducción de HbA1c > 0,5% en la semana 12 fue del 72% como máximo, indicando una reducción notable de la glucosa sanguínea, al considerar a los que no respondieron en otros inhibidores SGLT2.
Además, el porcentaje de pacientes con infección genital e infecciones del tracto urinario, efectos secundarios que pueden producirse de acuerdo con el mecanismo de inhibidores de SGLT2, fue de solo el 2%, verificando la seguridad destacada del fármaco. Esta tasa es significativamente menor a la tasa del 5–10% con los inhibidores SGLT2 de otras compañías.
El doctor Kyongsoo Park, el investigador coordinador de este ensayo, dijo: “Con el resultado del ensayo de fase 2 de enavogliflozin a través de la monoterapia de 200 sujetos coreanos, se verificó la seguridad y el efecto reductor de la glucosa sanguínea”. “Si esta eficacia y seguridad destacables se confirman a través de la monoterapia o terapia de combinación en fase 3, se espera que la enavogliflozin se utilice como una buena opción de tratamiento para los pacientes diabéticos de tipo 2”, añadió.
Sengho Jeon, consejero delegado en Daewoong, dijo: “Ante el excelente resultado de enavogliflozin, dedicaremos más esfuerzos a desarrollar el mejor inhibidor SGLT2 de la mejor clase”. “Aceleraremos la I+D con un objetivo de expansión del mercado global estableciendo asociaciones completas en el extranjero”, añadió.
Daewoong planea iniciar ensayos clínicos de fase 3 para varias indicaciones diabéticas múltiples dentro de este año. La compañía ha establecido un objetivo de lanzar el fármaco en Corea para 2023. Además, las indicaciones para enavogliflozin se expandirán a la obesidad, enfermedades cardiacas y enfermedades renales, además de la diabetes.
Foto – https://mma.prnewswire.com/media/1283020/EU_enavogliflozin_phase_2_clinical_trial.jpg